生物醫藥領域傳來一則振奮人心的消息:恒潤達生生物科技有限公司自主研發的CAR-T細胞治療產品,其新藥臨床試驗(IND)申請已正式完成國家藥品監督管理局藥品審評中心(CDE)的技術評審。這不僅是企業自身研發道路上的一座重要里程碑,更標志著我國在細胞技術,尤其是CAR-T這一尖端賽道的研發與應用正朝著產業化與規范化方向邁出堅實而關鍵的一步。
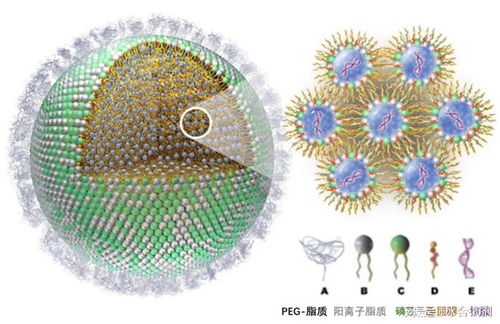
CAR-T(嵌合抗原受體T細胞)療法,作為近年來腫瘤免疫治療領域最具突破性的技術之一,通過基因工程手段改造患者自身的T細胞,使其能夠精準識別并高效殺傷腫瘤細胞。恒潤達生此次IND申請完成技術評審,意味著其產品的藥學、非臨床研究等核心數據獲得了監管機構的初步認可,證明了其在生產工藝、質量控制、有效性及安全性等方面具備了進入臨床階段的基本條件。這背后,是企業對細胞技術從基礎研發到工藝開發全鏈條的深厚積累與不懈攻堅。
技術的突破源于持續的創新與嚴謹的研發。恒潤達生團隊在CAR-T產品的研發過程中,很可能在靶點選擇、載體構建、細胞擴增工藝以及質量控制體系等環節實現了自主優化與創新。例如,通過設計更安全、更高效的CAR結構,以提升其抗腫瘤活性和持久性;或通過優化體外培養體系,確保細胞產品的均一性與穩定性,為大規模、標準化生產奠定基礎。完成技術評審,正是對這些“硬核”技術實力的權威檢驗與肯定。
從更宏觀的視角看,此次進展對我國細胞技術的整體發展具有多重積極意義。它豐富了國內CAR-T治療的產品管線,為更多血液腫瘤乃至實體瘤患者帶來了新的希望。它推動了相關技術標準與審評體系的完善,為后續同類產品的研發與申報提供了寶貴的實踐經驗與參考路徑。它彰顯了中國企業在全球細胞治療競爭格局中的創新活力與成長速度,有助于吸引更多資本與人才投入到這一前沿領域。
完成技術評審只是通向市場的漫長征程中的重要一環。恒潤達生的CAR-T產品將正式進入臨床試驗階段,這將是檢驗其真實世界療效與安全性的最終考場。我們期待這款凝聚著創新智慧的產品能夠在臨床試驗中取得優異成績,早日惠及廣大患者。我們也期待國內產學研各界能以此為契機,進一步加強在細胞存儲、自動化生產、降本增效等應用環節的協同創新,共同推動中國細胞治療產業從“并跑”向“領跑”跨越,讓更多“中國智造”的細胞技術成果驚艷世界,守護生命健康。